已知N2+3H2⇌2NH3,根据如图判断:
A是______的物质的量浓度变化情况.反应开始时,C(N2)=______;
2min时C(NH3)=______,0-2min内氢气的平均反应速率v(H2)=______.
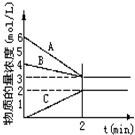
答案 : 随反应进行反应物的物质的量减小,生成物的物质的量增大,因此AB为反应物,C为生成物,反应消耗的物质的量之比等于化学计量数之比,图中变化量最大的为氢气;所以A为H2,B为N2,C为NH3;由图象可知反应开始时,C(N2)=4mol/L;2min时C(NH3)=2mol/L;
0-2min内氢气变化的浓度为△c(H2)=6-3mol/L=3mol/L,所以0-2min内氢气的平均反应速率v(H2)=
| △c(H2) |
| t |
| 3mol/L |
| 2min |
故答案为:H2;4mol/L;2mol/L;1.5mol/(L•min).
mA(气)+nB(气)⇌pC(气)+qD(气)的C%与时间t有如图关系
(1)若E、F表示两种温度,则E______F(填>、<或=),正反应______热
(2)若E、F表示两种压强,则m+n______p+q.
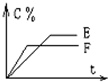
答案 : (1)F曲线到达平衡时间短,速率快,所以温度高,即温度E<F;升高温度,C%减小,平衡逆移,所以正方向为放热反应,故答案为:<;放;
(2)F曲线到达平衡时间短,速率快,所以压强大;增大压强,C%减小,平衡逆移,正方向为体积增大的方向,所以m+n<p+q,故答案为:<;
编辑推荐:
下载Word文档

温馨提示:因考试政策、内容不断变化与调整,长理培训网站提供的以上信息仅供参考,如有异议,请考生以权威部门公布的内容为准! (责任编辑:长理培训)






















点击加载更多评论>>