(1)我国首创的海洋电池,总反应为:4Al+3O2+6H2O=4Al(OH)3,负极为:______,负极发生:______反应(填“氧化”或“还原”);正极为铂网,______(填“电子”或“电流”)从铂极流出;海水为电解质溶液,海水中的Na+移向______(填“正极”或“负极”).
若电路中转移3mol电子,则负极材料质量减少______克
(2)航天技术使用氢氧电池具有高能、轻便,不污染优点,氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式均可表示为:2H2+O2=2H2O.酸式氢燃料电池的电解质是酸、其负极反应为:2H2-4e-=4H+,则正极反应为______;
碱式氢氧燃料电池的电解质是碱,其正极反应表示为:O2+2H2O+4e-=4OH-,则负极反应为:______.
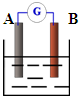
(3)如右图:若A为铜片,B为铁片,电解质为FeCl3溶液,则作铜片为______极(填正或负),写出电极反应式:正极______负极______.
答案 : (1)根据反应方程式知,负极是Al,负极失电子发生氧化反应;正极为铂网,电子从负极经外电路到正极,电流正好相反,从正极经外电路到负极;正极上聚集大量电子,根据异性相吸,所以钠离子移向正极.
4A1+3O2+6H2O=4A1(OH)3转移电子
4×27g12mol
27g 3mol
故答案为:Al;氧化;电流;正极;27.
(2)酸式氢燃料电池的电解质是酸、
电池总反应式均可表示为:2H2+O2=2H2O①
其负极反应为:2H2-4e-=4H+②,
则正极反应为 ①-②,即O2+4e-+4H+=2H2O;
碱式氢氧燃料电池的电解质是碱,
其正极反应表示为:O2+2H2O+4e-=4OH-③,
则负极反应为①-③,即2H2-4e-+4OH-=4H2O
故答案为:O2+4e-+4H+=2H2O;2H2-4e-+4OH-=4H2O.
(3)根据正负极材料的活泼性知,铁片作负极,铜片作正极;正极上 Fe3+得电子生成Fe2+,所以电极反应式为
2Fe3++2e-=2 Fe2+;负极上铁失电子生成Fe2+,所以电极反应式为Fe-2e-=Fe2+.
故答案为:正;2Fe3++2e-=2 Fe2+;Fe-2e-=Fe2+.
下列各项正确的是( )
| 电极反应式 | 出现环境 | |
| A | H2-2e-=2H+ | 碱性环境下氢氧燃料电池的负极反应 |
| B | 4OH--4e-=O2↑+2H2O | 中性环境下钢铁的吸氧腐蚀 |
| C | 2H++2e-=H2↑ | 用Cu作电极电解NaOH溶液的阴极反应 |
| D | H2-2e-=2H+ | 用惰性电极电解H2SO4的阳极反应 |
| A.A | B.B | C.C | D.D |
答案 : C
编辑推荐:
下载Word文档

温馨提示:因考试政策、内容不断变化与调整,长理培训网站提供的以上信息仅供参考,如有异议,请考生以权威部门公布的内容为准! (责任编辑:长理培训)






















点击加载更多评论>>