如图甲、乙是电化学实验装置。
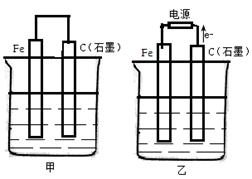
(1)若甲、乙两烧杯中均盛有NaCl溶液,则:
①甲中石墨棒上的电极反应式为 ;
②乙中总反应的离子方程式为 ;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2 。若反应中Cl2和I2的物质的量之比为5∶1,且 生成两种酸,该反应的化学方程式为 。
(2)若甲乙两烧杯中均盛有足量CuSO4溶液,则:
①甲中铁棒上的电极反应式为 ;
②如果起始时乙中盛有200mLpH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入的物质是 (写化学式),其质量为 g。
答案 :
(1)①2H2O+O2+4e-===4OH-;
②2Cl-+2H2O
 H2↑+Cl2↑+2OH-,
H2↑+Cl2↑+2OH-,③5Cl2+I2+6H2O===10HCl+2HIO3;
(2)①Fe-2e-===Fe2+;
②CuO(或CuCO3) 0.8g或1.24g。
关于下列各装置图的叙述中,不正确的是
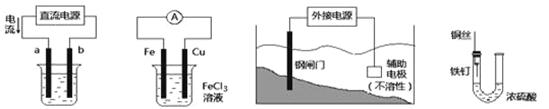
① ② ③ ④
| A.用装置①在铁件上镀铜,则a极为铜,电解质为CuSO4溶液 |
| B.装置②的总反应是:Fe +2Fe3+=3Fe2+ |
| C.装置③中钢闸门应与外接电源的正极相连 |
| D.装置④中的铁钉几乎没被腐蚀 |
答案 :
C
编辑推荐:
下载Word文档

温馨提示:因考试政策、内容不断变化与调整,长理培训网站提供的以上信息仅供参考,如有异议,请考生以权威部门公布的内容为准! (责任编辑:长理培训)






















点击加载更多评论>>