(1)欲配制500mL0.2mol/LNa2CO3溶液,回答下列问题:
(1)应称取______gNa2CO3•10H2O.
(2)配制该溶液所用的仪器有______.
(3)下列操作使所配溶液浓度偏低的是______
A、容量瓶未干燥即用来配制溶液B、往容量瓶转移溶液时有少量液体溅出
C、未洗涤溶解固体的烧杯D、定容时,仰视刻度线
(二)某化学小组在实验室用下图提供的仪器制备溴乙烷.
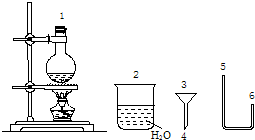
已知:
①反应原理:NaBr+H2SO4(较浓)
NaHSO4+HBr
HBr+C2H5OH
C2H5Br+H2O
②反应物用量:NaBr(S)25g,无水乙醇15mL,浓H2SO430mL,水15mL
③溴乙烷和乙醇的部分物理性质如表
回答下列问题:
(4)连接上述仪器的顺序是:1接______接______接(4)接(3)接______(填数字).你认为反应后溴乙烷在______(填“烧瓶”或“烧杯”)中
(5)由于浓硫酸具有强氧化性,反应产生副产物,使粗制溴乙烷常呈黄色,该副产物是______(写化学式),除去该杂质的试剂和方法是______,为了减少该副产物的生成,本实验采取了______的措施.
答案 : (一)(1)m=nM=CVM=0.2mol/L×0.5L×286g/mol=28.6g,故答案为:28.6;
(2)配制步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般天平称量固体,把氯化钠倒入烧杯进行溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器有玻璃棒、天平、药匙、烧杯、胶头滴管、500mL容量瓶,
故答案为:托盘天平、500mL容量瓶、烧杯、量筒、玻璃棒、胶头滴管;
(3)A、容量瓶未干燥即用来配制溶液,对溶质的物质的量和溶液的体积无影响,所以配制的溶液浓度无影响;
B、往容量瓶转移溶液时有少量液体溅出,导致溶质的物质的量偏小,配制的溶液浓度偏低;
C、未洗涤溶解固体的烧杯,导致溶质的物质的量偏小,配制的溶液浓度偏低;
D、定容时,仰视刻度线,导致溶液的体积偏大,所以配制溶液的浓度偏低;
故选BCD;
(二)(4)根据反应装置→导气装置→尾气处理装置连接仪器,所以连接顺序是1接 6接 5接4接3接 2;
溴乙烷的沸点较低,加热条件下能挥发从导管中流出,且溴乙烷不溶于水,所以会从烧杯中析出.
故答案为:6;5;2;烧杯;
(5)浓硫酸有强氧化性,能把溴化氢氧化生成溴,溴的溶解使粗制溴乙烷常呈黄色;溴能和氢氧化钠反应生成可溶性盐,所以可用氢氧化钠溶于除杂,然后分液除去溴;为了减少该副产物的生成,本实验采取了反应物中加入水,稀释浓硫酸,降低其氧化性,减少副产品溴的生成,
故答案为:Br2;NaOH溶液,分液取下层;反应物中加入水,稀释浓硫酸,降低其氧化性,减少副产品溴的生成.
(1)应称取______gNa2CO3•10H2O.
(2)配制该溶液所用的仪器有______.
(3)下列操作使所配溶液浓度偏低的是______
A、容量瓶未干燥即用来配制溶液B、往容量瓶转移溶液时有少量液体溅出
C、未洗涤溶解固体的烧杯D、定容时,仰视刻度线
(二)某化学小组在实验室用下图提供的仪器制备溴乙烷.

已知:
①反应原理:NaBr+H2SO4(较浓)
|
||
HBr+C2H5OH
| △ |
②反应物用量:NaBr(S)25g,无水乙醇15mL,浓H2SO430mL,水15mL
③溴乙烷和乙醇的部分物理性质如表
| 密度/g•mL-1 | 沸点/℃ | 溶解性 | |
| 溴乙烷 | 1.461 | 38 | 难溶于水 |
| 乙醇 | 0.789 | 78 | 易溶于水 |
(4)连接上述仪器的顺序是:1接______接______接(4)接(3)接______(填数字).你认为反应后溴乙烷在______(填“烧瓶”或“烧杯”)中
(5)由于浓硫酸具有强氧化性,反应产生副产物,使粗制溴乙烷常呈黄色,该副产物是______(写化学式),除去该杂质的试剂和方法是______,为了减少该副产物的生成,本实验采取了______的措施.
答案 : (一)(1)m=nM=CVM=0.2mol/L×0.5L×286g/mol=28.6g,故答案为:28.6;
(2)配制步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般天平称量固体,把氯化钠倒入烧杯进行溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器有玻璃棒、天平、药匙、烧杯、胶头滴管、500mL容量瓶,
故答案为:托盘天平、500mL容量瓶、烧杯、量筒、玻璃棒、胶头滴管;
(3)A、容量瓶未干燥即用来配制溶液,对溶质的物质的量和溶液的体积无影响,所以配制的溶液浓度无影响;
B、往容量瓶转移溶液时有少量液体溅出,导致溶质的物质的量偏小,配制的溶液浓度偏低;
C、未洗涤溶解固体的烧杯,导致溶质的物质的量偏小,配制的溶液浓度偏低;
D、定容时,仰视刻度线,导致溶液的体积偏大,所以配制溶液的浓度偏低;
故选BCD;
(二)(4)根据反应装置→导气装置→尾气处理装置连接仪器,所以连接顺序是1接 6接 5接4接3接 2;
溴乙烷的沸点较低,加热条件下能挥发从导管中流出,且溴乙烷不溶于水,所以会从烧杯中析出.
故答案为:6;5;2;烧杯;
(5)浓硫酸有强氧化性,能把溴化氢氧化生成溴,溴的溶解使粗制溴乙烷常呈黄色;溴能和氢氧化钠反应生成可溶性盐,所以可用氢氧化钠溶于除杂,然后分液除去溴;为了减少该副产物的生成,本实验采取了反应物中加入水,稀释浓硫酸,降低其氧化性,减少副产品溴的生成,
故答案为:Br2;NaOH溶液,分液取下层;反应物中加入水,稀释浓硫酸,降低其氧化性,减少副产品溴的生成.
编辑推荐:
下载Word文档

温馨提示:因考试政策、内容不断变化与调整,长理培训网站提供的以上信息仅供参考,如有异议,请考生以权威部门公布的内容为准! (责任编辑:长理培训)






















点击加载更多评论>>