(16分)硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如下:
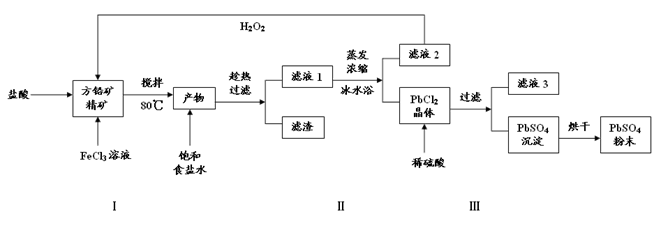
已知:(ⅰ)PbCl2(s)+2Cl-(aq)
 PbCl4-(aq) △H>0
PbCl4-(aq) △H>0(ⅱ)Ksp(PbSO4)=1.08×10-8, Ksp(PbCl2)=1.6×10-5
(ⅲ)Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的PH值分别为3.2、7.04
(1)步骤Ⅰ中生成PbCl2和S的离子方程式 ,加入盐酸的另一个目的是为了控制PH值在0.5~1.0,原因是 。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因 。
(3)写出PbCl2晶体转化为PbSO4沉淀的离子方程式 。
(4)请用离子方程式解释滤液2加入H2O2可循环利用的原因 ,滤液3是 。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的 PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为 。
答案 :
(16分)
(1)PbS+2Fe3++2Cl-= PbCl2+2Fe2++S(3分),抑制Fe3+、Pb2+的水解(2 分)
(2)用冰水浴使反应PbCl2(s)+2Cl-(aq)
 PbCl4-(aq)逆向移动,使PbCl4 -不断转化为PbCl2晶体而析出。(3分)
PbCl4-(aq)逆向移动,使PbCl4 -不断转化为PbCl2晶体而析出。(3分)(3)PbCl2(s)+SO42-(aq)
 PbSO4 (s) +2Cl-(aq) (2分)
PbSO4 (s) +2Cl-(aq) (2分)(4)2Fe2++ H2O2+2H+=2Fe3++2H2O(2分),盐酸(2分)
(5)PbSO4+2e-="Pb+" SO42-(2分)
编辑推荐:
下载Word文档

温馨提示:因考试政策、内容不断变化与调整,长理培训网站提供的以上信息仅供参考,如有异议,请考生以权威部门公布的内容为准! (责任编辑:长理培训)






















点击加载更多评论>>